pH metri
- Detalji
- Napisao/la Franjo Jović, dipl.kem.inž.
- Hitova: 36797

Uvod
Praćenje kvalitete akvarijske vode je glavni uvjet za omogućavanje kvalitetnog života akvarijskih ribica i biljaka. Da bismo mogli razumjeti procese koji se događaju u vodi, moramo je moći odgovarajuće analizirati.
Kvalitetna kemijska analiza vode je vrlo složena. Potrebno je koristiti mnogo metoda kojim dolazimo do kvalitetnih informacija. Uporaba različitih analitičkih metoda iznimno poskupljuje proces analize stoga ne čudi da se većina stvari uopće ne analizira. Istovremeno na tržištu postoje tzv. jednokratni testeri koji, na osnovi promjena boje, govore o parametrima akvarijske vode. Jedan od najbitnijih parametara akvarijske vode je pH vrijednost ili kiselost vode stoga ćemo ovaj članak posvetiti analitičkim metodama određivanja pH vrijednosti vode. Od davnina je poznat lakmus papir koji se temelji na promjeni boje ovisno o pH vrijednosti vode. Usporedbom boje koju pokazuje lakmus papir i boje na baždarnom (pokaznom) pravcu zaključuje se koja je pH vrijednost. Danas na tržištu postoje instrumenti, pH metri, koji su zapravo voltmetri sa specifičnim H+ ion selektivnim elektrodama.



Slika 1. Primjer par laboratorijskih pH metara
ANALITIČKA METODA
Analitička kemija je znanost koja razvija metode i alate nužne za dobivanje informacije o kemijskom sastavu i o njegovim promjenama s vremenom. Kvalitativnom kemijskom analizom utvrđuje se kemijski sastav tvari u uzorku (dokazivanje) a kvantitativnom kemijskom analizom utvrđuje se količina pojedine tvari u uzorku (određivanje). U akvaristici se većinom provode klasične kvalitativne kemijske analize. Pri tome znamo što tražimo i koliko toga ima u akvarijskoj vodi. Kako smo napomenuli ranije, postoje brzi testovi (slika 2) i postoje različite analitičke instrumentalne tehnike (slika 3.).

Slika 2. Kemijski reagensi za brze testove.
Među instrumentalne metode kvalitativne kemijske spadaju:
- razni senzori
- kromatografija (slika 3.)
- pretražne (masena spektrometrija, infracrvena spektroskopija isl.), i
- mikroskopske metode

Slika 3. Analitički kromatografski instrumentima u kemijskom laboratoriju DHMZ-a (www.meteo.hr).
ELEKTROKEMIJSKE ANALITIČKE METODE
Za mjerenje pH vrijednosti vodene otopine se koriste pH metri, voltmetri sa standardnom vodikovom elektrodom ( tzv. potenciometrijski senzori). Standardna vodikova elektroda mjeri elektrodni potencijal između vodikovih iona i vodika prema reakciji:
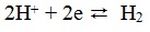
Standardni elektrodni potencijal se može izraziti preko Nernstove jednadžbe prikazane:
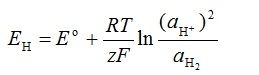
Za mjerenje, pH bi trebao mjeriti koncentracije redoks para H2/H+ no to je nepraktično jer bi nam trebao izvor plinovitog vodika. Ukoliko se koristi standardna staklena elektroda koja ima porozni stakleni mjehur (slika 4.) te u kojoj se nalazi unutarnja referentna elektroda, pufer otopina pH = 7 i staklena membrana, to je moguće izbjeći (jer je tada a(H2) =1). Najčešća elektroda za mjerenja pH je staklena elektroda s redoks parom Ag/AgCl koja se najčešće čuva u 3 M otopini KCl-a – otopina(I).Shematski se staklena elektroda, obzirom na redoks parove, prikazuje
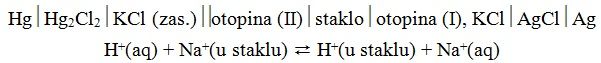
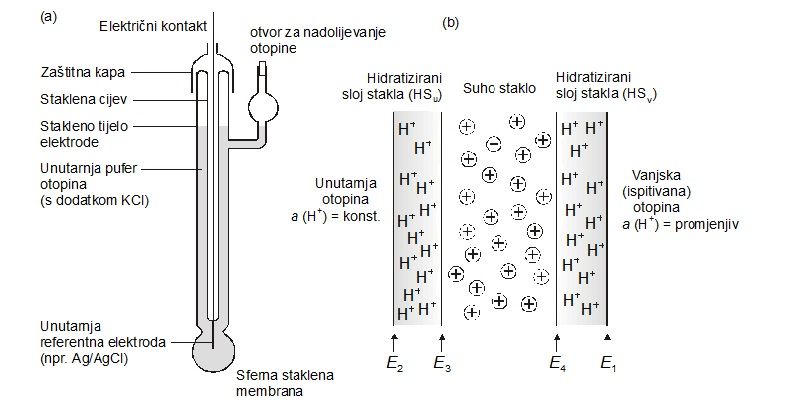
Slika 4. Prikaz (a) staklene elektrode i (b) presjek staklene membrane
Potencijal membrane mjeri se putem unutarnje referentne elektrode. Potencijal, koji je konstantan, i ukupni potencijal staklene elektrode je dan jednadžbom:
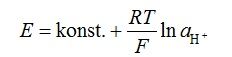
To je jednadžba pravca i na njoj se temelji mjerno načelo pH metara. Postoje različite vodikove- ion selektivne elektrode koje se temelje na različitim redoks parovima no sve više su staklene elektrode manje.
STAKLENA ELEKTRODA
Osim stakla, kao aktivnog elementa, upotrebljavaju se i drugi materijali u izradi membranskih elektroda za mjerenje aktiviteta određene ionske ili molekulske vrste (slika 5.). Istražen je velik broj materijala iz kojih se mogu prirediti homogene čvrste membrane s Nernstovim odzivom za određeni kation odnosno anion; i pokazalo se da su to u vodi teško topljive soli. Često se izrađuju membrane iz smjese dviju (rijetko više) kristalnih tvari od kojih je redovito samo jedna elektrokemijski aktivna.
Aktivna tvar membrane tvori, selektivno, komplekse samo s određenim ionima i na taj način, kroz granicu faza membrana – otopina, prolaze samo ioni koji s aktivnom tvari membrane tvore kompleks. Zbog toga je iznimno bitno da staklenu elektrodu NIKADA ne ostavljamo na suhom. Poželjno je da se drži u istom elektrolitu kao i otopina kojom je punjena. U nedostatku iste može se čuvati u puferskim otopinama (pH = 7) ili destiliranoj vodi.
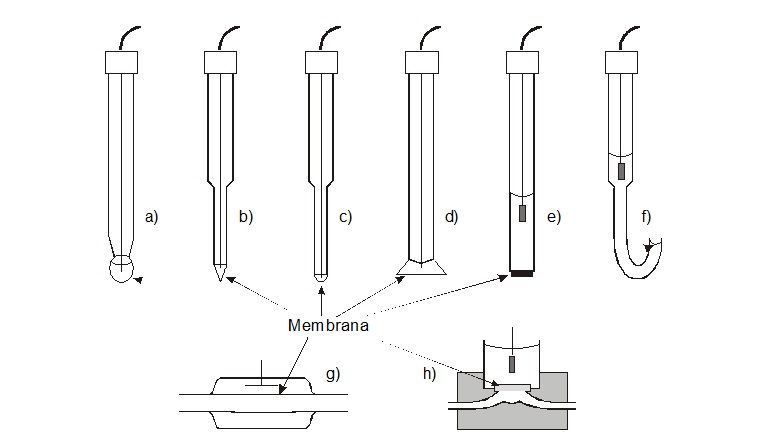
Slika 5. Izvedbeni oblici elektroda s čvrstom membranom
a) uobičajeni kuglasti oblik najčešći kod staklenih elektroda,
b) šiljasti oblik za utiskivanje u polutvrde materijale,
c) mikroelektroda za mjerenje u malim volumenima uzorka,
d) plosnati oblik za mjerenje na površini ili tankom sloju uzorka,
e) ravni, pločasti oblik, upotrebljava se u staklenih i čvrstih membrana,
f) konveksni oblik za male volumene ispitivanog uzorka,
g) protočni oblik sa staklenom membranom,
h) protočni oblik s čvrstom membranom.
KALIBRACIJA
U svrhu kvantitativnog određivanja sastava uzorka, metode instrumentalnih određivanja koncentracije vodikovih iona mogu biti apsolutne, tj. ne zahtijevaju kalibraciju da bi se dobio podatak o koncentraciji iz izlaznog signala instrumenta. Osjetljivost određivanja može se odrediti direktno iz teoretske ovisnosti signala i koncentracije. Potenciometrijska metoda (pH metrija) je relativna metoda i zahtijevaju kalibraciju.
Kalibracijski dijagrami
Kalibracijski ili baždarni dijagram prikazuje ovisnost signala prema pH vrijednosti vode dobiven mjerenjem signala serije standarda (standardnih puferskih otopina, obično pH = 4, pH = 7 i pH = 10) pri točno određenim uvjetima (temperaturi). Kalibracijski dijagrami nisu uvijek linearni. Često su kod niskih ili visokih koncentracija H+ iona krivulje, a linearni je dio negdje u sredini takvog dijagrama (slika 6).
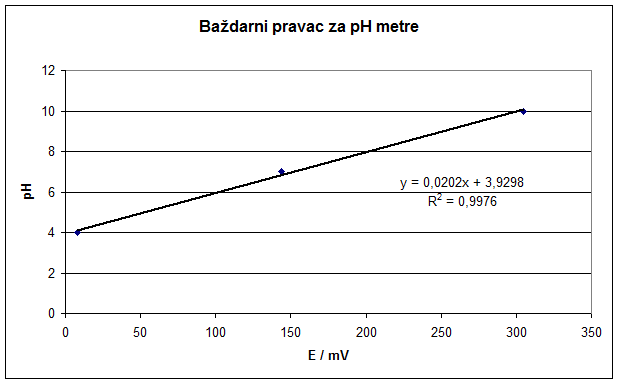
Slika 6. Primjer određivanja kalibracijskog dijagrama za pH metar
Kao što vidimo ovo je u skladu s Nernstovom jednadžbom: 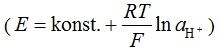 , pa je određivanjem potencijala pH elektrode moguće odrediti pH otopine
, pa je određivanjem potencijala pH elektrode moguće odrediti pH otopine 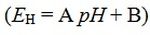 .
.
Primjer 1. Mjerenja pH akvarijske vode
Za usporedbu napravljen je paralelni test različitih pH senzora. JBLov tester 5 u 1. Prema testeru, pH vode je bio 8. Merckov indikator (lakmus za neutralno područje) je pokazao da je pH vode 6,5 a industrijski pH metar je pokazao pH = 6,95. Prema rezultatima može se vidjeti da, vrlo često, testeri za akvariste znaju jako odstupati.
Primjer 2. Baždarenje pH metra
Kalibracija mjernog instrumenta je linearizacija mjernog signala (u slučaju pH metra to je napon) u mjernu veličinu (pH). Ovisno o mjernom instrumentu (proizvođač, kvaliteta) kalibracija, baždarenje ili određivanje statičke karakteristike se svodi na određivanje minimalo dviju točaka (jer nam treba pravac).
1. korak je uroniti elektrodu u pufer pH=4 a instrument očitava napon, npr. 20 mV
2. korak je uroniti elektrodu u pufer pH=7 a instrument očitava napon, npr. 400 mV
3. korak je da instrument izračunava automatski statičku karakteristiku pH = konst1*U/mV + konst2.
4. Na osnovi izmjerenog napona (npr U = 350 mV), instrument očitava pH = 6,5.
Elektroda se sastoji od elektrode spojene na vanjski krug i otopine elektrolita u kojoj su ioni istog metala od kojeg je ona i načinjena. Npr. zasićena kalomel elektroda ima u sebi redoks par Hg/Hg2Cl2 u zasićenoj otopini KCl-a. Prema tome elektroda bi se trebala čuvati u zasićenoj otopini KCl-a. Ukoliko je elektroda Ag/AgCl u 3 M otopini KCl, onda bi se trebala čuvati u istoj takvoj otopini.
Već zadnjih 10ak godina baždarenja pH elektrode i uvijek prilikom baždarenja pH "klizi" ovisno o stupnju čistoće, stanju elektrode itd.
Postupak je:
- staklenu elektrodu čuvati u 3M otopini KCl-a. U slučaju nedostatka, sasvim normalno i uobičajeno je čuvati ju u običnoj destiliranoj vodi.
- prije mjerenja baždariti na dvije točke, ili čak na jednu točku, pri čemu je prva točka pH=0 --> U = 0 mV (izvor greške!!).
- isprati elektrodu između pufera i obrisati je ubrusom.
- nakon mjerenja je vratiti u destiliranu vodu ili otopinu KCl-a.
NAJČEŠĆA PITANJA:
-Kako kalibirirati pH metar?
1. Sondu izvaditi iz KCl, isprati u destiliranoj vodi i obrisati.
2. Staviti u pH = 7, držati je 5 minuta i podesiti kotačić na kontroleru za ph 7.
3. Isprati sondu u destiliranoj vodi, obrisati.
4. Staviti sondu u pH = 4, držati je 5 minuta i podesiti kotačić na kontroleru za pH 4.
5. Isprati sondu i proglasiti je kalibriranom.
-Pri kalibriranju pH = 4 i pH 7, nakon namještanja vratio sam sondu u pH = 4 i pokazivao je pogrešno?
Sve ponoviti od točke 2. Zna se događati i da se po 5 puta pokušava kalibrirati pH metar.
-Ma i kažu svakih par mjeseci kalibrirati, ali me zanimalo koliko često treba mijenjati sondu. Kad se više ne može kalibrirati i to je to? Ipak čuvanje u akvarijskoj vodi nije čuvanje u KCl-u?
Sondu(elektrodu) zapravo treba mijenjati kad dođe do mehaničkog kvara. pH elektroda je zapravo posrebrena žica, naknadno anodno oksidirana u kloru/kloridima pri čemu se taloži sol AgCl. Sve je uronjeno u 3 M KCl. (Nekada davno sam imao i recepturu kako napraviti AgAgCl elektrodu). Najproblematičniji dio je stakleni porozni vrh koji je specifično porozan (za H+ ione) i po mojem iskustvu, u preko 90% slučajeva, on prvi strada.Često dolazi i do stradanja kontakta na konektorima (dijela koji spaja žicu s vanjskim krugom) a on tada povećava otpor i pada napon. U slučaju akvarija, na njoj se uvijek i taloži biomasa koja dodatno smanjuje difuznost staklene membrane a ne preporuča je se mehanički prati jer je krhka.
-Kako izgledaju staklene elektrode?

To su elektrode, neki dan sam kopao po skladištu i našao ih 20ak komada. Stoje tu godinama. Ono što se naziva pH metar je zapravo univerzalni instrument, bolje rečeno voltmetar (veliki ulazni otpor). Teorijski, potrebna je samo pH elektroda i voltmetar (ili dvije Ag/AgCl referente elektrode različitih koncentracija KCl-a).
-Može li se pH elektroda puniti?
Unutar nje se većinom nalazi 3 M KCl koji tijekom vremena difundira iz nje a ioni iz vode u nju.
-Što može biti krivo za lošu kalibraciju odn. zašto se događa da se to mora ponoviti?
Prije svega, difuzija drugih iona, pri čemu dolazi do interferencije. Mogu se paralelno taložiti svi anioni (karbonati, sulfati, fosfati itd.) iz vode ali i kationi mogu intereferirati s kloridima (kalcij, magnezij itd.). U otopini postoje ravnoteže svih ionskih vrsta. Te ravnoteže su opisane konstantama i može se točno reći što najviše smeta. Koncentracije svih iona utječu na napon, a sve su opisane Nernstovom jednadžbom/ama. Pritom se uspostavlja na elektrodi nešto što se zove mješoviti ili mirujući potencijal (u slučaju korozije se zove i korozijski potencijal). Kako se on vremenom mijenja, potrebno je kalibrirati elektrodu.
-Koliki je životni vijek ovih jeftinih elektroda? Je li problem to što su stalno u akvariju?
Životni vijek doslovno svih referentnih elektroda je dug, naravno ukoliko se dobro održavaju. Nema potrebe držati elektrodu u akvariju već ju je bolje držati u otopini kojom je punjena (3M KCl).
-Ima potrebe jer joj je namjena da stalno bude u akvariju i spojena je na kontroler pH koji preko elektromagnetnog ventila pusta ugljični dioksid u akvarij!
U redu, u slučaju da je spojena na regulacijski krug možda bi je trebalo povremeno provjeriti. Moj savjet je da bi bilo potrebno pregledati razinu otopine KCl u elektrodi i ovisno o tome je napuniti ukoliko je razina niža te je ponovno kalibrirati.

