Simulacije fizikalno kemijskih procesa u akvariju
- Detalji
- Napisao/la Dr. sc. Franjo Jović, dipl.kem.inž.
- Hitova: 11693
 Akvarij je kompleksan dinamički sustav kojim upravljaju kemijske reakcije i fizikalni procesi prijenosa tvari. Svi ti procesi su dobro opisani u literaturi pomoću teorijskih jednadžbi. Jednadžbe su vrlo često kompleksne (parcijalne diferencijalne jednadžbe) i za njihovo rješavanje je potrebno dobro poznavati matematiku. Procesni simulatori (npr. Aspen, DynoChem, ChemCAD) omogućuju njihovo numeričko rješavanje. Svi procesi u akvariju se mogu opisati elementarnim stupnjevima (slika 1.), od kojih najsporiji definira ukupnu brzinu fizikalno-kemijske promjene. Često nije moguće ad hoc definirati koji stupanj je najsporiji, već ga je potrebno odrediti na osnovu mjerenja i/ili matematičkih simulacija. U ovome slučaju ćemo ih probati odrediti matematičkim simulacijama u DynoChem-u za različite slučajeve.
Akvarij je kompleksan dinamički sustav kojim upravljaju kemijske reakcije i fizikalni procesi prijenosa tvari. Svi ti procesi su dobro opisani u literaturi pomoću teorijskih jednadžbi. Jednadžbe su vrlo često kompleksne (parcijalne diferencijalne jednadžbe) i za njihovo rješavanje je potrebno dobro poznavati matematiku. Procesni simulatori (npr. Aspen, DynoChem, ChemCAD) omogućuju njihovo numeričko rješavanje. Svi procesi u akvariju se mogu opisati elementarnim stupnjevima (slika 1.), od kojih najsporiji definira ukupnu brzinu fizikalno-kemijske promjene. Često nije moguće ad hoc definirati koji stupanj je najsporiji, već ga je potrebno odrediti na osnovu mjerenja i/ili matematičkih simulacija. U ovome slučaju ćemo ih probati odrediti matematičkim simulacijama u DynoChem-u za različite slučajeve.
Simulacija
Matematički model se sastoji od jednadžbi koje opisuju elementarne procesne stupnjeve.
Za slatkovodne akvarije se mogu pretpostaviti sljedeći stupnjevi (slika 1.):
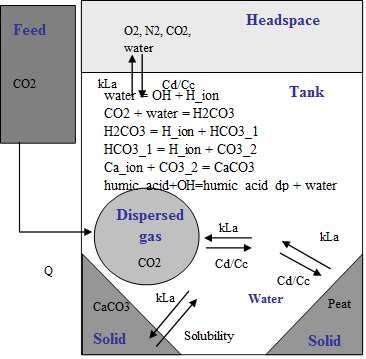
1. Ulijevanjem tvrde zagrebačke vode u akvarij se uspostavlja kemijska ravnoteža disocijacija vode, definirana konstantom produkta topljivosti vode Kw = 10-14. Može se pisati i kao: pH + pOH = 14.
2. Zbog povećane tvrdoće vode (obično je dH = 20) uspostavlja se kemijska ravnoteža između karbonata, koji za posljedicu imaju povećavanje pH, koji je obično pH = 7 - 8.
3. Topljivost plinova (O2, N2 i CO2) u akvarijskoj vodi je definirana ravnotežnim koncentracijama pri sobnoj temperaturi, c(O2) = 8,3 mg L-1. (www.engineeringtoolbox.com/gases-solubility-water-d_1148.html). Brzina otapanja je definirana konstantom prijenosa tvari, kLa / s-1 koja ovisi o kontaktnoj površini (npr. difuzori povećavaju kontaktnu površinu) i miješanjem (npr. ispust iz filtera, namreškana voda povećava brzinu otapanja). Konstanta kLa se kreće od 0,01 do 1 s-1, pri čemu veći broj znači bolje miješanje.
4. Vrlo često se u akvarijsku vodu upuhuje plinoviti CO2, pri čemu se uspostavlja fizikalna ravnoteža topljivosti CO2 u vodi, definirana konstantom topljivosti, Kpt, ili koncentracijom zasićenja pri sobnoj temperaturi, c(CO2) = 0,8 g L. Brzina otapanja CO2 je definirana konstantom prijenosa tvari, kLa / s-1 koja je definirana kontaktnom površinom (mjehurima) i miješanjem.
5. CO2 reagira s vodom pri čemu tvori karbonatnu kiselinu koja disocira u dva stupnja (pKa1 = 6,367, pKa2 = 10,329). Ovo je kemijski stupanj.
6. U akvariju se nalazi i kamenje koje ima određeni sadržaj kalcijevog karbonata (dodatno se talože karbonati zbog tvrde vode) pa postoji fizikalna ravnoteža između krutog i otopljenog kalcijevog karbonata, definirana koncentracijom zasićenja pri sobnoj temperaturi, c(CaCO3) = 1,5 g L-1. Brzina taloženja/otapanja je definirana konstantom prijenosa tvari, kLa. Ova konstanta prijenosa tvari, kLa je različita od prethodno navedenih jer se odnosi na ravnotežu kruto-kapljevito.
7. U akvariju se može staviti kruti treset koji prirodno omekšava vodu. Topljivost je mala, c(huminske kis.) < 0,01 g L-1, a brzina ispuštanja huminskih kiselina je definirana konstantom prijenosa tvari. Ovo je fizikalni proces.
8. Otopljene huminske kiseline kemijski reagiraju tako da neutraliziraju OH- ione i povećavaju kiselost akvarijske vode. Brzina neutralizacije je definirana konstantom ravnoteže. U osnovi su sve neutralizacije jako brze reakcije.
Na dinamiku kemijskih ravnoteža jako utječu i biljke koje troše CO2 i ispuštaju O2, te ribe koje disanjem troše O2 i ispuštaju CO2. Kako je to jako nedefiniran proces koji je izrazito nestacionaran, ovisi o količini biljaka i riba a mijenja se i tijekom ciklusa dana i noći, ovim modelom nisu razmatrani ti procesi.
Svi ovi elementarni stupnjevi mogu biti spori stupnjevi, a također i limitirajući faktor, stoga ćemo razmotriti različite slučajeve koji se mogu pojaviti.
Procesni simulator DynoChem označava prvo fazu, a zatim tvar/molekulu/ionsku vrstu (npr. Solid.CaCO3 označava krutu fazu i količinu/masu kalcijevog karbonata u njoj dok Tank.CaCO3 označava količinu otopljenog kalcijevog karbonata u akvarijskoj vodi).
Pretpostavke modela (inicijalne vrijednosti)
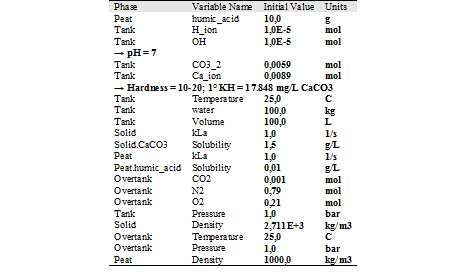
Prikazat ćemo nekoliko najčešćih slučajeva koji se pojavljuju u akvaristici.
Razumijevanjem procesa u akvariju možemo bolje reagirati u određenim situacijama. U svojim pokušajima da riješe problem akvaristi često učine veću štetu, a ovim člankom ćemo pokušati objasniti i zašto.
1. Slučaj – Tvrda voda; treset u filteru
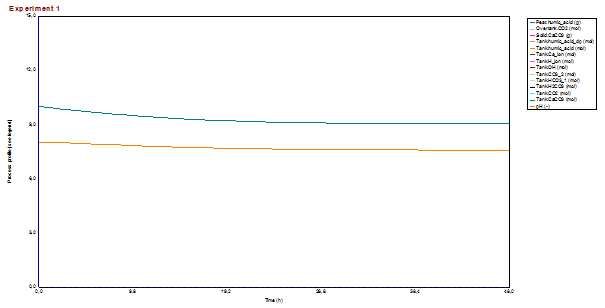
- huminske kiseline se počinju otapati (Tank.humic_acid) a kako se otapaju tako disociraju (Tank.humic_acid) i zatim neutraliziraju OH- ione (Tank.OH)
- posljedica toga je smanjivanje pH ali i otapanje (otpuštanje) huminskih kiselina iz treseta što se vidi na sljedećem prikazu.
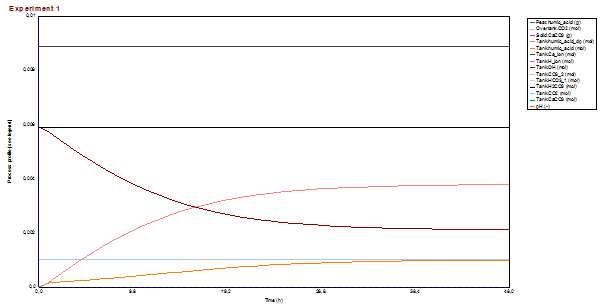
- koncentracija kalcijevih iona je nepromijenjena (Tank.Ca_ion) što je u skladu jer kalcijevi ioni ne reagiraju s huminskim kiselinama.
2. Slučaj - Tvrda voda, pokušavaj smanjivanja pH s "pH minus" sredstvom
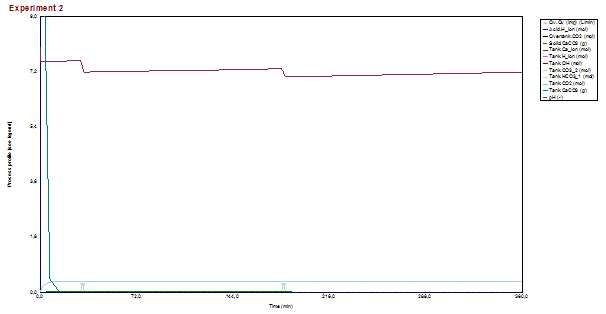
- u 30-oj i 180-oj minuti smo dodali malu količinu "pH minus" sredstva, spustili smo pH sa preko 7,5 na ispod 7 u prvom trenutku, no nakon određenog vremena se pH vratila na vrijednost 7,3 zbog postojanja pufera
- novi dodatak kiseline će uzrokovati smanjenje pH ispod 7, a postojanje pufera će uzrokovati novu ravnotežu i konačni rast pH od 7,2 nakon 360 minuta.
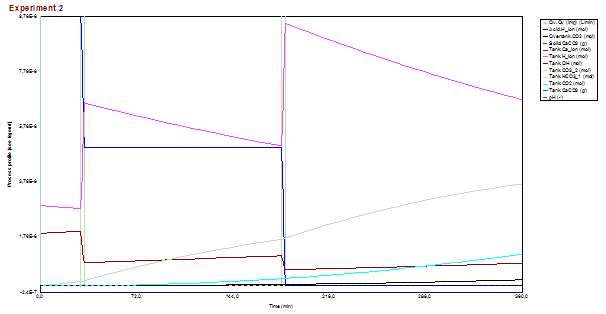
- zbog ravnoteže između karbonata i hidrogenkarbonata, višak vodikovih iona se troši na neutralizaciju karbonatnih iona pa raste količina hidrogenkarbonata (Tank.HCO3_1) tako da se smanjuje količina vodikovih iona (Tank.H_iona) koji bi trebali biti zaslužni za smanjivanje pH. To je glavni razlog zašto se ne može djelotvorno sniziti pH tijekom duljeg vremenskog perioda.
3. Slučaj – Meka voda, uvođenje CO2

- uvođenje ugljičnog dioksida (CO2) ima za posljedicu njegovo otapanje u mekoj vodi i stvaranje karbonatne kiseline, koja zatim disocira povećavajući koncentraciju vodikovih iona uslijed čega dolazi do sniženja pH (do čak ispod 6).
- istovremeno se povećava sadržaj karbonata te se povećava karbonatna tvrdoća, kH.
Zaključak
Procese koji se događaju u akvariju moguće je predvidjeti. Procesni simulatori i upotreba matematičkih modela mogu omogućiti dobro predviđanje kemijskih i fizikalnih procesa koji se događaju u akvariju.
Na taj način svaki problem može biti prethodno otklonjen jer u slučaju pojavljivanja problema, zbog životne sredine živih bića, često zna biti i fatalan.